NEK1 유전자 변이, 신경세포 섬모 기능 손상과 세포 사멸로 이어져
HDAC6 억제제, 신경세포 기능 회복 가능성 확인
정밀의학 기반 치료제 개발 및 신경퇴행성질환 토토사이트 승인전화x에 기여
한양대학교 김승현 의학과 교수 연구팀이 루게릭병(근위축성 측삭경화증, ALS)의 새로운 발병 기전을 세계 최초로 규명하며, 맞춤형 치료 전략의 가능성을 열었다.
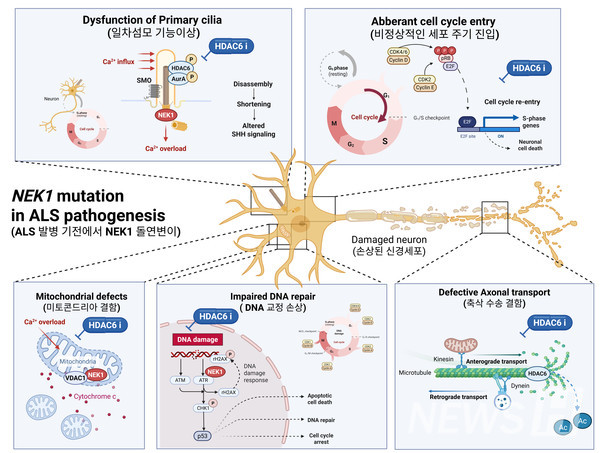
연구에 따르면, 루게릭병 환자에게서 나타나는 NEK1 유전자 변이가 신경세포의 일차섬모(primary cilium) 형성에 결함을 일으키고, 이로 인해 칼슘 신호 전달 체계와 미토콘드리아 기능에 이상이 생기며 결국 세포 사멸로 이어지는 병태생리 경로가 존재한다. 연구팀은 HDAC6 억제제를 투여했을 때 이러한 세포 기능이 회복되는 효과를 확인함으로써, 향후 치료제로서의 활용 가능성을 제시했다.
김 교수는 "NEK1 유전자 변이는 주로 서구의 가족성 루게릭병 환자에서 보고돼 왔지만, 본 연구에서는 국내 산발성 ALS 환자 920명을 대상으로 한 전장유전체 분석(WES)을 통해 2.5%의 환자에서 해당 유전자 변이를 확인했다"며 "이는 국내 환자에게도 유전적 요인이 일정 부분 작용하고 있음과 변이가 운동신경세포에 주는 병리학적 영향을 규명한 첫 연구라는 점에서 의의가 있다"고 말했다.
NEK1 유전자 변이와 HDAC6 억제제의 활용 가능성
이번 연구는 NEK1 유전자 변이가 일차섬모의 기능에 영향을 준다는 점에서 출발했다. 김 교수는 "운동신경세포는 출생 후 세포분열을 멈추고 G0 상태에 머무르기 때문에 일차섬모의 역할이 특히 중요하다"며 "NEK1이 중심체에서 세포주기와 물질 수송에 관여하는 점에 착안해, 해당 유전자의 기능 소실이 칼슘 항상성 파괴와 미토콘드리아 이상을 초래할 수 있다는 가설을 세웠고, 이를 운동신경세포 모델에서 입증했다"고 설명했다.
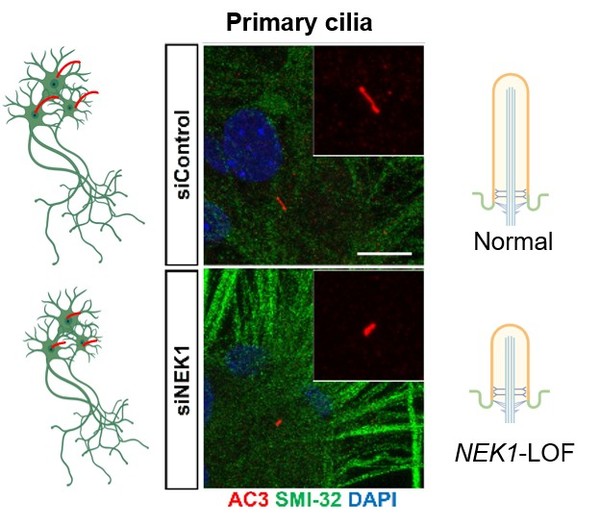
일차섬모는 세포 외부의 신호를 감지하고 이를 세포 내로 전달하는 감각기관의 역할을 한다. 특히 polycystin-2(TRPP2) 채널을 통해 칼슘 유입을 조절하는 기능을 갖는다. 섬모의 구조나 기능이 손상되면 칼슘 조절에 이상이 생겨 세포 내 칼슘 스파이크가 과도하게 발생하고, 완충능력 저하로 인해 미토콘드리아에 손상을 유발하게 된다. 특히 에너지 수요가 높고 칼슘과 결합하는 단백질이 상대적으로 적은 운동신경세포는 이러한 변화에 더욱 취약하다.
연구팀은 NEK1 유전자에 변이가 있는 유도만능줄기세포(iPSC, induced Pluripotent Stem Cell) 기반 운동신경세포 모델에서 미토콘드리아 단편화와 막 전위 감소를 확인했으며, 이는 칼슘과 미토콘드리아 간의 결합 장애에서 비롯된 결과로 분석했다. 김 교수는 "이와 같은 섬모-칼슘-미토콘드리아 축의 붕괴는 신경세포 퇴행을 유도하는 핵심 경로가 될 수 있음을 시사한다"고 강조했다.
또한 이번 연구에서는 HDAC6 억제제가 NEK1 결핍 뉴런에서 섬모 길이를 회복시키고, 미토콘드리아의 수송과 형태를 개선하는 효과가 있음을 확인했다. HDAC6는 α-튜불린 탈아세틸화를 통해 미세소관 안정성과 섬모 유지, 미토콘드리아 수송을 조절하는 단백질로, 이를 억제하면 신경세포 기능 회복에 기여할 수 있다. 김 교수는 "HDAC6 억제제가 적응증 확대를 목적으로 활발히 개발 중인 만큼, ALS 치료제로의 전환 가능성 또한 기대할 수 있다"면서도 "실제 치료제 개발을 위해서는 유효성과 함께 충분한 안전성 확보가 전제돼야 한다"고 말했다.
신경퇴행성질환, 나아가 정밀의학까지의 확장 가능성
연구에 활용된 '환자 유래 섬유아세포 및 줄기세포 유래 운동신경세포 모델'(iPSC-MNs)은 특이적 병리현상을 세포 수준에서 정밀하게 분석할 수 있다는 점에서 큰 장점이 있다. 연구팀은 환자의 피부세포에서 확인된 섬모 결함이 동일하게 iPSC-MNs에서도 재현되는 것을 확인했다. 김 교수는 "iPSC 기반 플랫폼은 유전적 배경이 보존된 환자 세포에서 질환 메커니즘을 규명하고, 치료제 후보물질을 선별해 바이오마커를 발굴할 수 있다는 점에서 맞춤형 치료와 정밀의학의 핵심 도구로 자리잡을 것이다"고 강조했다.
김 교수 연구팀이 증명한 병태기전은 루게릭병뿐만 아니라 알츠하이머병, 파킨슨병, 헌팅턴병 등 다른 신경퇴행성 질환에도 적용 가능성이 크다. 김 교수는 "세포 내 신호 전달 장애, 칼슘 항상성 붕괴, 미토콘드리아 스트레스는 여러 퇴행성 질환에서 공통적으로 나타나는 요소이다"며 "본 연구가 제시한 '섬모-칼슘-미토콘드리아' 경로는 다양한 질환 연구에도 확장 가능할 것이다"고 말했다.
이번 연구는 한양대병원 신경과, 한국뇌연구원, 경희대학교가 공동으로 참여했으며, 과학기술정보통신부의 뇌과학원천기술개발사업(Small RNA 기반 스트레스과립체 항상성 조절을 통한 뇌단백병증 제어기술 개발)의 지원을 받아 수행됐다. 김 교수는 "오랜 시간 함께 연구해온 연구자들이 각기 다른 기관으로 자리를 옮긴 뒤에도 협업을 이어간 덕분에, 연구의 깊이와 폭이 확장될 수 있었다"며 의생명연구원 노민영 박사, 한국뇌연구원 남민엽 박사, 경희대학교 오성일 교수의 기여를 함께 강조했다.
희귀질환을 진료하고 연구하는 의사, 김승현 교수

한편, 김 교수는 '생명의 신비상'을 비롯해 보건복지부 장관 표창, 미래창조과학부 장관 표창 등 다양한 상을 수상하며 연구 성과를 대외적으로 인정받아왔다. 그는 "가톨릭재단의 생명의 신비상은 희귀질환 연구자로서 가장 기억에 남는 상이다"며 "무엇보다 환우들이 치료 및 회복에 대한 긍정적인 반응을 보일 때 가장 큰 보람이 느껴진다"고 말했다.
국내·외 학술 활동을 활발히 이어온 김 교수는 아시아 루게릭병학회(PACTALS) 창립자이자, 대한치매학회 및 신경근육질환학회 회장 등을 역임하며 학계 발전에 기여했다. 그는 "젊은 시절 부족한 영어 실력에도 포기하지 않고 국제 학회와 저널에 꾸준히 발표하며 교류한 결과, 우리나라 연구도 세계적 수준에 도달할 수 있다는 자신감을 얻었다"며 "이러한 경험이 후배 연구자들에게도 용기와 동기부여가 되기를 바란다"고 말했다.
신경퇴행성질환 치료제 개발의 향후 과제를 묻는 질문에는 "신경퇴행성질환은 노화와 밀접하게 연관돼 있어 완전한 극복은 어렵지만, 병의 진행을 늦추고 삶의 질을 높이는 방향으로는 충분히 대응할 수 있다"고 답했다. 이어 그는 "내가 축적한 지식과 경험이 다음 세대의 더 큰 성과를 위한 디딤돌이 되길 바라며, 언젠가 누군가는 내 연구를 바탕으로 더 큰 도약을 이루길 기대한다"고 바람을 남겼다.
관련기사
- 희망한대 리더 그룹 ‘키다리은행X한가지’, 캠퍼스 속 지속가능성을 실천하다
- "세대 갈등에 질문을 던지다" 토토사이트 펫 학생들이 선보인 포럼연극, ‘어서
- 세상과 온기를 나눈 콜로세움 토토인들의 이야기, 2025-1 사회봉사 교과목 우수사례 공모전 시상식
- 한양인의 구강건강을 책임진다, 토토사이트 계정탈퇴 구강보건의 날
- 한양대 미래먹튀검증사이트 토토사이트융합연구센터, 세계화 속 지속가능한 K-컬처 발전 위해
- 3x3 토토사이트를 나의 언어로 답하다, 한양대 숙의 콜로키움
- 지속 가능한 환경경영 설계자, 세계 상위 2% 라오스 스포츠토토 노태우 교수 < 교수
- [한칭찬] 이연재 학생, 나눔을 실천하는 따뜻한 삶

 '한양위키' 키워드 보기
'한양위키' 키워드 보기